Изображения страниц
Текст статьи Кикоин А. К. Как получают низкие температуры // Квант. — 1972. — № 1. — С. 12—19.

Никто точно не знает, когда люди научились добывать огонь и искусственно нагревать тела до температуры выше окружающей среды. Во всяком случае, это случилось десятки тысяч лет тому назад, в эпоху, известную под названием каменного века.
А вот дата получения искусственного холода известна довольно точно.
Будем условно считать, что низкие температуры — это температуры ниже тех, что естественным образом возникают при изменении погоды.
Впервые такую низкую температуру
Почему же искусственно создавать высокие температуры люди умеют с незапамятных времён, а искусственный холод им удалось создать лишь совсем недавно?
С одной стороны, это связано с тем, что в высоких температурах люди больше нуждались, чем в низких.
С другой стороны, возможной причиной «отставания» техники получения низких температур является то обстоятельство, что высокие (но не слишком) температуры получать несравненно проще, чем низкие. В самом деле, достаточно чиркнуть спичкой, чтобы получить температуру вчетверо более высокую, чем комнатная. А Фарадею для того, чтобы получить температуру только вдвое ниже комнатной, понадобилось создать далеко не простое устройство.
Это «неравноправие» способов получения высоких и низких температур не случайно. В нём находит отражение один из основных законов природы, так называемый второй закон термодинамики (напомним, что первый закон термодинамики — это закон сохранения энергии).
На первый взгляд кажется, что охладить какое-нибудь тело очень просто: нужно это тело привести в контакт с другим телом более низкой температуры. Тогда от охлаждаемого тела к холодному само собой будет переходить тепло, что и приведёт к требуемому охлаждению; если есть лёд, то нетрудно сделать и мороженое!
Но как быть, если тело нужно охладить до такой низкой температуры, что подходящего другого холодного тела, к которому само собой могло бы переходить тепло, не существует? Тогда, очевидно, такое холодное тело, или, как говорят, хладоагент нужно создать искусственно. Вот в этом и состоит задача техники получения холода. Однако при изготовлении хладоагента тоже необходимо обеспечить теплоотдачу от него к какому-то другому телу, но не более холодному, потому что такого тела нет, а более тёплому, например, окружающей среде (воздуху, воде и т. п.).
Прежде всего выясним, какая в этом таится трудность.
Порядок и беспорядок в веществе
Вспомним, что температура тела определяется энергией беспорядочного теплового движения его атомов и молекул. Понизить температуру — значит уменьшить беспорядок, царящий среди молекул.
Что же такое беспорядок? Если каждый предмет в вашей квартире всегда находится на определённом закреплённом за ним месте и найти его всегда легко, то вы поддерживаете в своей квартире порядок. Если же вещи кладутся куда попало, то найти их нелегко. В вашей квартире беспорядок.
Чем больше размеры вашей квартиры, тем больше времени вам потребуется для того, чтобы отыскать ту или иную вещь, если вещи равномерно разбросаны, — тем больший беспорядок в вашей квартире. Представьте себе, что вещи в комнате могут сами двигаться, меняя своё положение. Тогда найти их станет ещё труднее, причём тем труднее, чем больше скорости их движения.
Этот житейский пример помогает нам понять, как определить, что такое порядок и беспорядок в молекулярном мире. Степень беспорядка определяется вероятностью обнаружить молекулу (или другую частицу) в каком-нибудь определённом состоянии, например, в определённой точке пространства.
Если имеется заданное количество частиц, равномерно распределённых в данном объёме, то вероятность обнаружения частицы в данной точке будет тем больше, чем медленнее движутся частицы, чем медленнее они меняют своё положение в заданном объёме. Но скорости молекул определяются температурой тела. Поэтому чем выше температура тела, тем больше степень беспорядка среди молекул, из которых оно состоит. Из предыдущего ясно также, что степень молекулярного беспорядка тем больше, чем больше объём, предоставленный частицам.
Таким образом, степень беспорядка зависит от двух факторов — от температуры тела и от его объёма.Увеличение температуры при заданном объёме, так же как и увеличение объёма при постоянной температуре, приводит к увеличению степени беспорядка среди молекул.
Оказывается, все процессы, которые происходят в природе, в замкнутой предоставленной себе системе (т. е. в системе, состоящей из частиц, взаимодействующих друг с другом, но не с другими телами), проходят так, что степень беспорядка возрастает. И когда эта степень беспорядка достигает самого высокого значения, все процессы сами собой прекращаются. Наступает состояние, которое называется состоянием равновесия.
Представьте себе шарики двух цветов, расположенные в определённом порядке. Нужны были немалые старания, чтобы расположить шарики в правильной последовательности. Но достаточно лёгкого толчка, чтобы с трудом созданный порядок нарушился и шарики беспорядочно перемешались. И никакими толчками восстановить исходный порядок невозможно. Вероятность такого события ничтожно мала.
А вот пример уже из атомно-молекулярного мира. Бросив кусок сахара в воду, мы легко получим раствор, в котором молекулы сахара распределены по всему объёму сосуда. Но сколько бы мы ни ждали, раствор никогда сам собой не разделится на воду и сахар. Для того чтобы получить сахар и воду отдельно, нужно затратить определённую энергию, нагрев раствор и испарив воду.
Физический смысл второго закона термодинамики и заключается в утверждении, что порядок и беспорядок в природе «неравноправны», что все сами собой идущие процессы установления равновесия сопровождаются ростом беспорядка. В нём и кроется причина того, что высокие температуры легче получать, чем низкие. При увеличении температуры тела (при сохранении его объёма) увеличивается беспорядок. Охлаждать же тела — значит увеличивать порядок, т. е. действовать, так сказать, «против природы».
Тем не менее охлаждать тела, оказывается, всё-таки можно. Можно, следовательно, заставить тепло переходить не от тёплого тела к холодному, а, напротив, от охлаждаемого тела к телам более тёплым. Таким образом создают хладоагенты.
Беспорядок — физическая величина
Слова «порядок» и «беспорядок», которыми мы здесь пользовались, кажутся на первый взгляд какими-то ненаучными, взятыми из повседневной жизни.
В действительности за этими словами скрывается физическое понятие настолько важное, что оно выражается специальной величиной.
Эта величина, выражающая степень беспорядка или порядка (порядок — это просто отсутствие беспорядка), называется энтропией.Обозначают её буквой
Во всех процессах, которые происходят с телами, важна не энтропия, а именно изменение энтропии. (В этом отношении энтропия похожа на потенциальную энергию тела. Во всех задачах важна не сама потенциальная энергия, а её изменение.)
Особый интерес представляет для нас случай, когда процесс происходит так, что к телу не подводится и от него не отводится тепло:
Адиабатное изменение объёма
В технике искусственного получения холода нас интересуют главным образом процессы изменения объёма тел, процессы их расширения и сжатия. Именно они играют здесь особенно важную роль.
Представим себе, что у нас имеется тело, которое мы расширяем или сжимаем адиабатно, т. е. без подвода или отвода тепла.
Мы уже знаем, что увеличение объёма тела с данным количеством частиц приводит к увеличению степени беспорядка, т. е. к увеличению энтропии.
Но наш процесс адиабатный, при котором
Таким образом, мы сразу получаем способ понижения температуры тела. Нужно данное тело адиабатно расширить, т. е. увеличить его объём. Адиабатное расширение как раз и является одним из главных способов получения холода.
Одной из разновидностей расширения является испарение жидкости. Ещё древние египтяне хранили напитки в пористых сосудах. Поры увеличивают поверхность испаряющейся жидкости и тем самым увеличивают скорость её испарения. Испарение же приводит к охлаждению жидкости. Плохая теплопроводность материала стенок и большая скорость испарения обеспечивали адиабатность процесса испарения.
Таким образом, вопрос о способах искусственного охлаждения сводится к вопросу о том, что расширять и как расширять.
Что расширять?
Ясно, что твёрдые тела для расширения непригодны — они не могут сколько-нибудь заметно изменять свой объём. По тем же причинам непригодны и жидкости. Хотя увеличение объёма жидкостей при их испарении и используется для их охлаждения, особенно низкие температуры таким образом получить нельзя, потому что, охлаждаясь, жидкость непременно в конце концов отвердевает. Так что наинизшая температура, которую можно получить при испарении жидкости, это температура её отвердевания. А для веществ, жидких при комнатной температуре, температуры отвердевания не так уж низки.
Лучше всего использовать газы. Газы способны к неограниченному расширению, а если они к тому же предварительно сжаты до высокого давления, то и масса их достаточно велика и потому достаточно велика и теплоёмкость этого газа. Для газов характерен и наибольший беспорядок в движении частиц. А так как наша задача — уменьшить беспорядок, то ясно, что лучше начинать с такого вещества, у которого беспорядок велик, чтобы было что уменьшать!
Итак, наиболее подходящим веществом для нашей задачи является газ. С другой стороны, конечный продукт, т. е. готовый хладоагент, лучше всего иметь в виде жидкости: жидкость всегда создаёт хороший тепловой контакт с погруженным в неё телом. Поэтому техника низких температур часто (но не исключительно) сводится к сжижению того или иного газа.
Как известно, в жидкость может быть превращён любой газ.
Но для каждого газа существует определённая температура, называемая критической температурой
Для получения умеренного холода используются газы с высокими значениями
Самые же низкие температуры получают сжижением газов, критические температуры которых много ниже комнатной. К ним относятся: кислород, у которого
Сжижать эти газы не так-то просто. Для этого их надо очень сильно охладить.
Как расширять?
Расширять газ можно по-разному. Наиболее «популярны» и чаще всего применяются два способа расширения.
Способ первый. Расширять лучше всего сжатый газ. Поэтому при любом способе расширения начинают с того, что газ сжимают при помощи специальной машины — компрессора — до давлений в десятки, а иногда и в сотни атмосфер. При этом газ нагревается по той же причине, по которой он охлаждается при расширении. Чтобы избежать нагрева газа (какой же смысл греть то, что нужно охлаждать?), газ после сжатия охлаждают проточной водой, которой и передаётся выделяющееся при сжатии тепло. Таким образом при сжатии обеспечивается постоянство температуры. На рисунке 1 показана схема установки для охлаждения по первому способу. Компрессор обозначен буквой К, а буквой Т обозначен теплообменник, в котором сжатый газ проходит через змеевик, омываемый проточной водой. Здесь газ восстанавливает свою первоначальную температуру. После этого он поступает в детандер Д, который представляет собой простой поршневой двигатель. Здесь газ, толкая поршень, расширяется адиабатно, совершая при этом механическую работу. Охлаждается он именно потому, что совершает работу. Ведь при адиабатном процессе расширения, когда тепло извне не подводится, работа может совершаться только за счёт уменьшения кинетической энергии молекул газа.
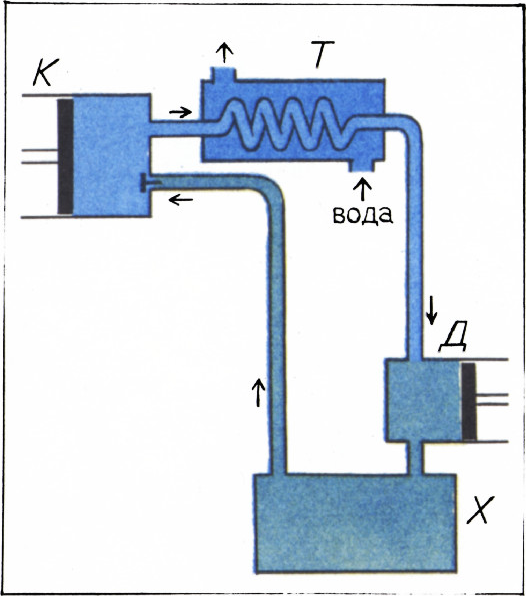
После охлаждения в детандере газ попадает в холодильную камеру Х, где он используется для охлаждения любых помещённых в неё тел. Отнимая у них тепло, газ нагревается и возвращается в компрессор, чтобы пройти весь цикл снова.
Мы видим, что действие установки сводится к тому, что газ отнимает тепло от охлаждаемых в холодильной камере тел и передаёт тепло воде в теплообменнике Т. Осуществляется, таким образом, передача тепла от холодного к тёплому, т. е. то, что «естественным» образом никогда не происходит. За это нарушение «естественного» хода вещей приходится, однако, «платить», и «платой» служит работа, совершаемая компрессором.
Детандерный способ отличается высоким эффектом охлаждения, но у него есть недостатки. Во-первых, это необходимость смазки в детандере, что при очень низких температурах создаёт некоторые трудности. Во-вторых, этот способ действует тем хуже, чем ниже температура. Наконец, в детандере неудобно доводить охлаждение до сжижения. По этим причинам детандерный способ часто применяют в комбинации с другим способом расширения.
Способ второй. Этот способ расширения отличается тем, что эффективность его с понижением температуры растёт, так что он особенно удобен для получения самых низких температур.
В отличие от первого способа, здесь газ после компрессора К и теплообменника Т (рис. 2) направляется прямо к холодильной камере, но попадает туда через особый кран, называемый дросселем. Устроен дроссель так, что в нём гасится скорость газового потока (слово «дроссель» означает именно эту его особенность) и газ проходит через него настолько медленно, что давление как перед дросселем, так и после него остаётся всё время постоянным: до дросселя оно такое, какое создаётся компрессором, а после дросселя оно равно, например, одной атмосфере.
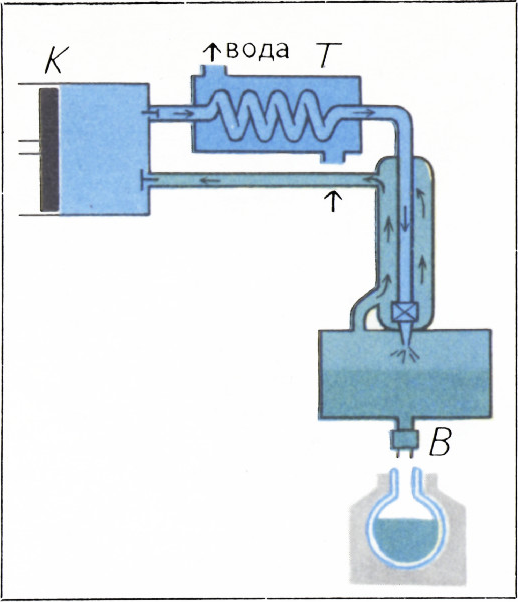
Проходя через дроссель, газ не совершает работы — он не толкает поршень, не вращает турбину. Тем не менее, адиабатное расширение при дросселировании приводит к охлаждению газа. Объясняется это тем, что молекулы газа взаимодействуют между собой. Когда при расширении газа молекулы удаляются друг от друга, производится работа против молекулярных сил, связывающих молекулы, и кинетическая энергия молекул, а, значит, и температура газа, понижается. Можно сказать, что и здесь совершается работа, но не против внешних сил, как в детандере, а против внутренних сил сцепления между молекулами.
Эффект охлаждения газа при дросселировании называется эффектом Джоуля—Томсона.
Для эффекта Джоуля—Томсона важно, что газ не идеален, т. е. его молекулы взаимодействуют друг с другом на расстоянии, а не только при непосредственном «лобовом» столкновении. Идеальный газ при дросселировании не охлаждался бы. Его можно было бы охладить, только используя детандер.
Как уже указывалось, охлаждение при дросселировании тем сильнее, чем ниже температура. При комнатной температуре, с которой приходится начинать, оно невелико. Для того чтобы, несмотря на это, достигнуть значительного охлаждения, прибегают к остроумному приёму, сущность которого ясна из рисунка 2.
Труба, по которой сжатый газ поступает к дросселю, помещена в другую, более широкую трубу. Когда после дросселирования газ слегка охладится, он возвращается из холодильной камеры к компрессору по широкой трубе, охлаждая «по дороге» встречный сжатый газ. Поэтому следующая порция газа подойдёт дросселю более холодной. Пройдя через дроссель, газ ещё больше охладится, а возвращаясь по внешней трубе, ещё сильнее охладит встречный газ. Через некоторое время к дросселю подойдёт уже настолько холодный газ, что дросселирование приведёт к его сжижению, и в камере Х появится первая порция жидкости. Теперь по широкой трубе будет уходить холодный пар этой жидкости, продолжая охлаждать встречный газ.
Холодную жидкость, скопившуюся в холодильной камере, можно тут же использовать для охлаждения других тел. Иногда этим «другим» телом служит соляной раствор, который затем поступает к трубам, проложенным в прилавках магазинов, под площадкой искусственного катка и т. д. Но можно поступить и иначе: сжиженный газ слить через кран В в специальные сосуды, пригодные для хранения и транспортировки холодных жидкостей (сосуды Дьюара). Полученную таким образом жидкость можно использовать для охлаждения других тел в любом месте и в любое время. Обычно машины, в которых охлаждённый газ или жидкость используются как хладоагент в холодильной камере, называются рефрижераторами. Машину же, предназначенную для выдачи жидкого продукта, называют ожижительной машиной.
Дросселирование — наиболее часто используемый способ охлаждения. Оно, в частности, используется и в домашних холодильниках.
Здесь необходимо сделать одно существенное дополнение.
Дело в том, что дросселирование может приводить не только к охлаждению, но и к нагреванию газа.
И для каждого газа существует определённая температура, так называемая температура инверсии эффекта Джоуля—Томсонa
Ещё ближе к абсолютному нулю
Описанные выше способы охлаждения позволяют обратить в жидкость любые газы, включая и гелий.
Гелий кипит при атмосферном давлении при температуре
Как же добраться до температур в тысячные доли градуса?
Напомним, что понизить температуру — это значит уменьшить ту часть беспорядка, которая зависит от температуры. Для этого мы использовали газ, у которого беспорядок велик. Но ведь при температурах, близких к абсолютному нулю, степень беспорядка уже так мала, что уменьшать её очень трудно. При таких температурах все вещества (кроме гелия) твёрдые, так что рассчитывать на адиабатное изменение объёма нельзя. Значит, надо найти такие вещества, у которых даже при этих температурах ещё существует беспорядок, зависящий не только от температуры и объёма. И такие вещества физики нашли. Это некоторые сложные парамагнитные вещества.
Парамагнитное вещество — это вещество, содержащее частицы (атомы, ионы, молекулы), которые ведут себя как маленькие магнитики.
Из-за теплового движения эти магнитики ориентированы совершенно беспорядочным образом.
Правда, при низких температурах, когда тепловое движение очень ослаблено, силы взаимодействия между магнитиками могли бы заставить их расположиться правильным образом.
Но если магнитики находятся на значительных расстояниях один от другого, то сил взаимодействия не хватает на это, и магнитный беспорядок сохраняется до самых низких температур.
Так обстоит дело в очень сложных по составу парамагнитных солях, в которых, кроме магнитных частиц, есть много других, немагнитных, например в соли
Беспорядок в парамагнитном веществе может изменяться не только при изменении его температуры, но и при изменении его магнитного состояния. А магнитным состоянием вещества можно управлять точно так же, как и объёмом вещества. Это можно делать с помощью магнитного поля. Если парамагнитную соль поместить в постоянное магнитное поле, то все магнитики — ионы выстроятся параллельно силовым линиям магнитного поля. Мы наведём порядок в ориентации ионов. Убрав поле, снова создадим беспорядок. Это совершенно аналогично сжатию и расширению газа.
Для получения низких температур поступают следующим способом.
Парамагнитную соль в ампуле А, заполненной газообразным гелием и находящейся в сосуде с жидким гелием, температура которого около
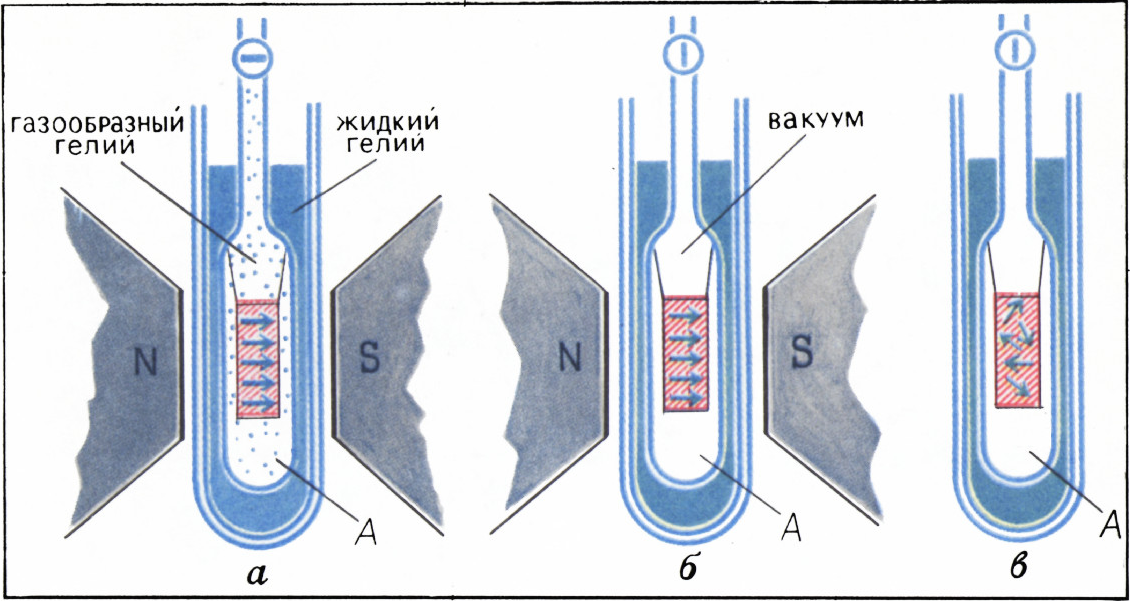
Описанным способом вот уже почти сорок лет получают так называемые сверхнизкие температуры, т. е. температуры ниже тех, что можно получить с помощью только жидкого гелия. Наинизшие температуры, получаемые таким образом, это тысячные доли градуса.
Не только атомы, но и атомные ядра являются магнитиками, правда, в 1000 раз более слабыми.
Всё же, если начать не с
Упражнения
- Почему расширение в детандере и в дросселе можно считать адиабатными процессами?
- Можно ли при магнитном способе охлаждения использовать не парамагнитные, а ферромагнитные вещества?
- В каких единицах измеряется энтропия? Какая ещё физическая величина измеряется в таких единицах?
Ответы, указания, решения
- В детандере процесс расширения протекает настолько быстро, что теплоотдача не успевает произойти.
- Нельзя. Потому что в ферромагнетиках элементарные магниты не разориентированы. Намагниченность ферромагнетиков, особенно при низких температурах, практически не зависит от магнитного поля. Они намагничиваются до насыщения в слабых
- В джоулях/кельвин. В таких же единицах измеряется теплоёмкость тела (не удельная, а полная).







